Bakgrunnur og rannsóknarhönnun
Retatrútíð (LY3437943) er nýtt lyf sem inniheldur eitt peptíð og virkjarþrír viðtakar samtímis: GIP, GLP-1 og glúkagon. Til að meta virkni og öryggi þess hjá einstaklingum með offitu en án sykursýki var framkvæmd 2. stigs, slembiraðað, tvíblind, samanburðarrannsókn með lyfleysu (NCT04881760). Samtals338 þátttakendurmeð líkamsþyngdarstuðul ≥30 eða ≥27 ásamt að minnsta kosti einum þyngdartengdum fylgisjúkdómi, var slembiraðað til að fá lyfleysu eða retatrútíð (1 mg, 4 mg með tveimur skammtaaukningaráætlunum, 8 mg með tveimur skammtaaukningaráætlunum eða 12 mg) gefið einu sinni í viku með inndælingu undir húð í 48 vikur.aðalendapunkturvar prósentubreyting á líkamsþyngd eftir 24 vikur, þar sem aukaendapunktar voru meðal annars þyngdarbreyting eftir 48 vikur og flokkunarleg þyngdartapsþröskuldar (≥5%, ≥10%, ≥15%).
Lykilniðurstöður
-
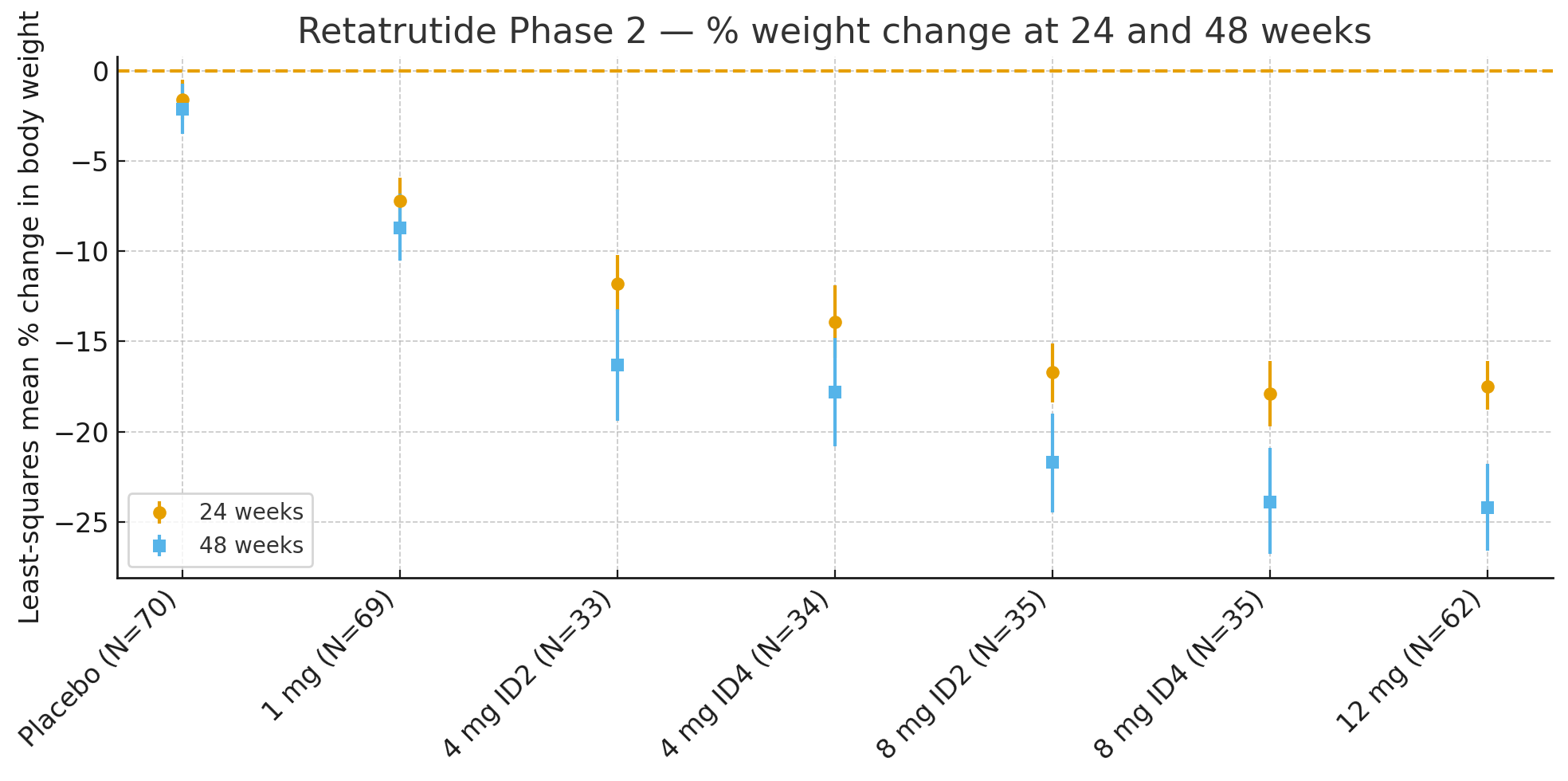
24 vikurMeðaltalsbreyting líkamsþyngdar miðað við upphafsgildi, samkvæmt minnstu kvaðrata aðferðinni, í prósentum var
-
Lyfleysa: −1,6%
-
1 mg: −7,2%
-
4 mg (samanlagt): −12,9%
-
8 mg (samanlagt): −17,3%
-
12 mg: −17,5%
-
-
48 vikurPrósentubreyting á líkamsþyngd var
-
Lyfleysa: −2,1%
-
1 mg: −8,7%
-
4 mg (samanlagt): −17,1%
-
8 mg (samanlagt): −22,8%
-
12 mg: −24,2%
-
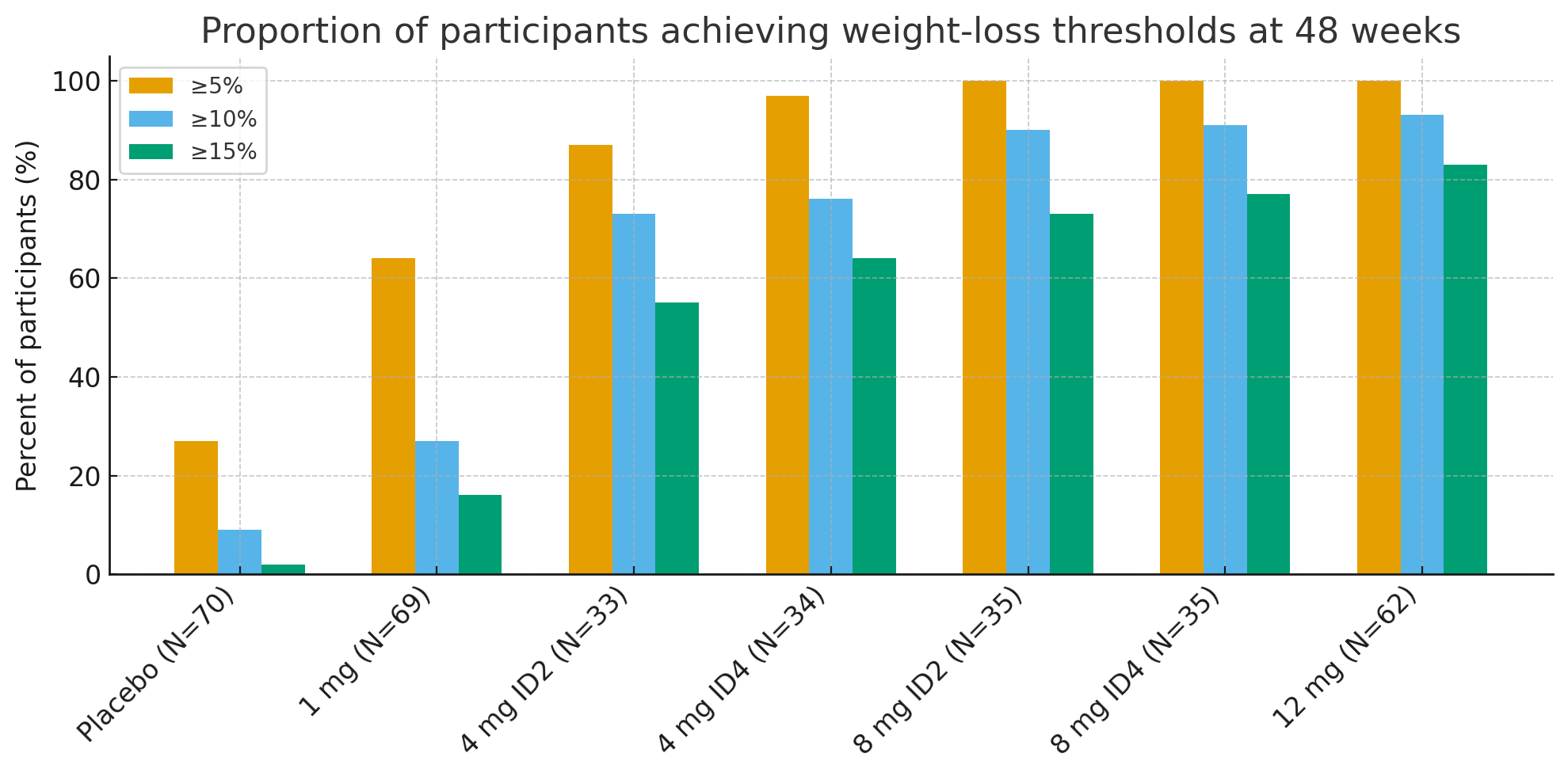
Eftir 48 vikur var hlutfall þátttakenda sem náðu klínískt marktækum þyngdartapsþröskuldum sláandi:
-
≥5% þyngdartap: 27% með lyfleysu samanborið við 92–100% í virkum hópum
-
≥10%: 9% með lyfleysu samanborið við 73–93% í virkum hópum
-
≥15%: 2% með lyfleysu samanborið við 55–83% í virkum hópum
Í 12 mg hópnum, allt að26% þátttakenda léttust ≥30% af upphafsþyngd sinni, þyngdartap sem er sambærilegt við offituaðgerð.
Öryggi
Algengustu aukaverkanirnar voru frá meltingarvegi (ógleði, uppköst, niðurgangur), yfirleitt vægar til miðlungsmiklar og skammtaháðar. Lægri upphafsskammtar (2 mg títrun) drógu úr þessum aukaverkunum. Skammtatengd aukning á hjartslætti sást, náði hámarki í 24. viku og minnkaði síðan. Tíðni hættumeðferðar var á bilinu 6–16% hjá virkum hópum, nokkuð hærri en hjá lyfleysu.
Niðurstöður
Hjá fullorðnum með offitu án sykursýki framkallaði vikuleg gjöf retatrútíðs undir húð í 48 vikurveruleg, skammtaháð lækkun á líkamsþyngd(meðaltaliðagigt allt að ~24% við hæsta skammt), ásamt framförum í hjarta- og efnaskiptamörkum. Aukaverkanir frá meltingarvegi voru tíðar en hægt var að stjórna þeim með skammtaaðlögun. Þessar niðurstöður í 2. stigs rannsóknum benda til þess að retatrútíð gæti verið nýtt meðferðarviðmið fyrir offitu, þar til staðfesting fæst í stærri, langtíma 3. stigs rannsóknum.
Birtingartími: 28. september 2025